
Otázka: Enzymy
Předmět: Biochemie
Přidal(a): vnl.xf
Biochemie – Enzymy
- Složení enzymů
- Názvy enzymů
- Třídy enzymů
- Aktivní centra enzymů
- Princip enzymové katalýzy
- Význam enzymů pro praktickou medicínu
Enzymy = biokatalyzátory – umožňují chemické reakce v organismu
- zpomalují, urychlují, zastavují chemické reakce
- bez katalyzátoru by neprobíhali chemické reakce v těle člověka
- zřetězení reakce do dějů a u každé reakce je jiný enzym
- => ovlivňují druh výsledného produktu
- dokonalejší než umělé katalyzátory
- účinnější
- umožňují reakci za nevýhodných podmínek
- snadná regulace
- vysoká specifičnost
- substrátové – reaktant, výchozí látka
- reakční – enzym na substrátu schopen provést jen určitou změnu
- velké množství enzymů v buňkách
- bílkovina jednoduchá globulární
- složená bílkovina globulární
- apoenzym + kofaktor
- apoenzym – bílkovina
- kofaktor – nebílkovinná část
- připojen pevnou vazbou = prosthetická skupina
- připojen slabě = koenzym (oddělitelné)
- rozdílné složení
- nejstarší přípona – in
- dnes přípona – asa
- celý název: substrát/y + typ reakce + asa
- 6 tříd
- oxidoreduktázy – př. alkoholdehydrogenasa
- transferázy – př. acetyltransferaza
- hydrolasy – př. lipázy
- lyasy – př. dekarboxylasy
- isomerazy
- lipázy
Aktivní centra enzymů = malá oblast enzymu má vazebnou a katalytickou funkci
- do určitých míst ústí určité funkční skupiny (teorie „zámek a klíč“, nebo teorie „indukovaného přizpůsobení“)
- enzym je schopen malinko se pozměnit
- součástí jsou kofaktory
- multienzymové komplexy – více bílkovinných podjednotek (různá specifičnost), zpracování 1 substrátu různými reakcemi př. syntéza mastných kyselin
- proenzymy = zymogeny – buňky vyrobí enzym v neúčinné foě (proenzym), na správném místě, kde má fungovat se kus odhalí a enzym má volné aktivní centrum a může pracovat př. úeúsinogen -> pepsin
- snížení aktivační enegie EA – vznik meziproduktů s enzymem
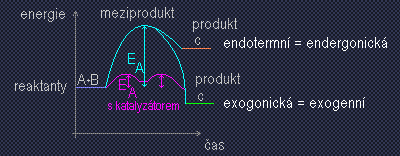
- A + BC -> AB + C
- A + BC -> A … B… C (meziprodukt) -> AB + C
- A + BC + E (katalíza) -> A + C – E – B -> AB + C + E
- E podporují přiblížení reaktantů
- vyjádření katalitické aktivity E A
- katal (kat) – množství aktivity, které přeméní 1 mol substrátu na 1 sec
- mezinárodní jednotka – U – 1 mikromolsubstrátu/1 sec
- faktory ovlivňující enzymovou katalízu
- teplota – urychlení reakce, nebezpečí tepelné denaturace, maximum 40-50°C
- pH – aktivita enzymů v úzkém rozmezí = pH optimum (v těle 7 pH)
- koncentrace enzymu – syntéza a denaturace enzymu je ovlivněna koncentrací v buňce, což je ovlivněno geneticky a produkty
- koncentrace substrátu – vliv až do nasycení enzymu
- ionty kovů – aktivují enzym, několik typů zastavení (inhibace) činnosti enzymů
- kompetitivní – inhibitor a substrát se váže na stejné místo, reverzibilní – koncentrace látek přinadbytku substrátu vyštve inhibitor a bude se měnit substrát, inhibitor je příbuzná látka substrátu, inhibitor i produkt působí reakce i zpětnou vazbu
- nekompetetivní – vazba inhibitoru na jiné místo enzymu – vratná/nevratná deformace aktivního centra (enzymové jedy)
- alosterické enzymy – zvláštní skupina enzymů má aktivní centruma další místo na vazbu efektoru, který způsobí inhibici enzymu nebo aktivaci enzymu
- rozdělení enzymů – v určitých organelách buňky a v cytoplasmě
Význam enzymů pro praktickou medicínu
- A – diagnóza – při poškození buěk jsou přítomny intracelulární enzymy v krvi
- B – stanovení různých látek – enzym slouží k přesnému určení látky
- C – léčebné zásahy – substituce trávicích enzymů, emzymoterapie př. Wobenzym
Zdroje najdete uvedeny zde:


