![]()
Otázka: Prvky p3 (pentely)
Předmět: Chemie
Přidal(a): Eliška 🙂
Charakteristika prvků p3 – pentelů
- prvky 15. (V.A) skupiny, p3 prvky, pentely
- dusík, fosfor, arsen, antimon, bismut
- mají 5 valenčních elektronů, el. konfigurace ns2 np3
- od fosforu mají volné d orbitaly → schopny excitace:
- 1) ns2 np3, trojvazné, ox. č. III/-III
- 2) ns1 np3 nd1, pětivazné, ox. č. V
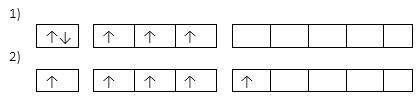
- dusík není schopen excitace, i přesto ale může mít ox. č. V – jedna z vazeb je koordinační
- s rostoucím Z roste kovový charakter prvků – dusík a fosfor jsou nekovy, arsen a antimon polokovy, bismut kov
- s rostoucím Z klesá jejich reaktivita a také kyselost
- stabilní el. konfiguraci nejčastěji získávají tvorbou tří kovalentních vazeb – pak mají ox. č. –III
- se vzrůstajícím Z roste stabilita sloučenin s ox. č. III a klesá stabilita sloučenin s ox. č. V arsen, antimon a bismut jsou v přírodě málo rozšířené, nacházejí se především ve formě sirných rud a používají se např. na výrobu slitin
- rozpustné sloučeniny arsenu jsou jedovaté a používají se k hubení hlodavců (např. arzenik – oxid arsenitý As4O6)
Dusík
- 2 stabilní izotopy – 14N (99,5 %) a 15N
- výskyt:
- volný v atmosféře ve formě dvouatomových molekul (78 obj. %), vzduch je proto hlavním zdrojem dusíku
- vázaný:
- v anorganických sloučeninách, např. v minerálech chilský ledek NaNO3 a draselný ledek (salnitr) KNO3, dále v amonných solích a dusitanech
- v organických sloučeninách, např. v bílkovinách, nukleových kyselinách, je to biogenní prvek
- vlastnosti a reakce:
- bezbarvý plyn, bez chuti a zápachu, málo rozpustný ve vodě, kyselinotvorný, nehořlavý
- ve všech skupenstvích tvoří dvouatomové molekuly N N, trojná vazba je pevná → nízká reaktivita
- oxidační čísla od –III do V
- ve sloučeninách může být maximálně čtyřvazný
- nejelektronegativnější prvek (X = 3,1)
- vzhledem k vysoké elektronegativitě je schopen vytvářet vodíkové vazby
- za běžných podmínek se neslučuje ani s velmi reaktivními prvky
- zvýšením teploty a tlaku se reaktivita podstatně zvyšuje, protože dojde k rozštěpení molekuly N2 na samostatné atomy, které jsou velmi reaktivní a slučují se s mnohými prvky
- příprava:
- termickým rozkladem dusitanu amonného:
- NH4NO2 → N2 + 2 H2O
- termickým rozkladem dusitanu amonného:
- výroba:
- frakční destilací zkapalněného vzduchu
- použití:
- přepravuje se stlačený v tlakových ocelových lahvích se zeleným pruhem
- při výrobě různých sloučenin – amoniaku, kyseliny dusičné, dusíkatých hnojiv
- elementární dusík se pro svou malou reaktivitu uplatňuje jako ochranný plyn tvořící inertní atmosféru všude tam, kde není žádoucí styk látek se vzdušným kyslíkem (např. při výrobě výbušnin)
- tekutý dusík se používá jako chladivo (tv = – 196 °C)
- amoniak:
- dříve nazýván čpavek
- za běžných podmínek bezbarvý plyn štiplavého zápachu a svíravé chuti
- díky vodíkovým vazbám, které tvoří, má ve srovnání s hydridy ostatních prvků 15. skupiny vysokou teplotu tání
- je mimořádně dobře rozpustný ve vodě (NH3.H2O, dříve NH4OH – hydroxid amonný) o dobré rozpouštědlo
- v přírodě se tvoří rozkladem organických sloučenin obsahujících dusík
- volný elektronový pár na dusíku způsobuje jeho zásaditý charakter, je schopen vázat proton H+ za vzniku NH4+
- má redukční vlastnosti:
- 3 CuO + 2 NH3 → 3 Cu + 3 H2O + N2
- laboratorně se připravuje rozkladem amonných solí silnými zásadami:
- NH4Cl + NaOH → NH3 + NaCl + H2O
- průmyslově se vyrábí tzv. Haber-Boschovou syntézou, tedy vysokotlakou katalyzovanou syntézou prvků:
- N2 (g) + 3 H2 (g) -> 2 NH3 (g)
- použití:
- výroba průmyslových hnojiv obsahujících amonné soli nebo dusičnany
- výroba kyseliny dusičné, sody
- kapalný jako chladicí médium
- reaguje s kyselinami za vzniku amonných solí
- s vodou amoniak částečně reaguje:
- NH3 + H2O ↔ NH4+ + OH–
- amonné soli:
- obsahují kation NH4+
- většinou jsou bezbarvé (bílé), krystalické, ve vodě rozpustné, tepelně nestálé (uvolňuje se amoniak)
- nejznámější je chlorid amonný, tzv. salmiak NH4Cl – používá se při pájení kovů a v lékařství
- dusičnan amonný NH4NO3 se používá jako průmyslové hnojivo
- oxidy:
- jsou složkou výfukových plynů a průmyslových exhalací
- většinou jsou dráždivé a jedovaté
- způsobují kyselé deště
- meziprodukty výroby kyseliny dusičné
- vznikají při redoxních reakcích dusíkatých sloučenin
- oxid dusný N2O:
- rajský plyn
- bezbarvý, nasládlé chuti, málo rozpustný ve vodě
- jeho směs s vodíkem při styku s plamenem vybuchuje
- vdechováním malého množství N2O nastává stav veselosti a opojení, při intenzivní inhalaci působí jako narkotikum
- používal se v anesteziologii k narkózám, jako náplň do bombiček (např. se šlehačkou)
- oxid dusnatý NO:
- bezbarvý plyn
- radikál, má nepárový elektron
- velmi reaktivní
- snadno se oxiduje na oxid dusičitý
- lze ho připravit přímou syntézou za vysokých teplot:
- N2 + O2 → 2 NO
- oxid dusitý N2O3:
- rozpouštěním ve vodě vzniká kyselina dusitá:
- N2O3 + H2O → 2 HNO2
- rozpouštěním ve vodě vzniká kyselina dusitá:
- oxid dusičitý NO2:
- červenohnědý jedovatý plyn
- vzniká při špatném uchovávání kyseliny dusičné
- radikál
- snadno tvoří dimer, tím se stabilizuje (N2O4)
- silné oxidační činidlo
- používá se jako okysličovadlo v raketové technice
- oxid dusičný N2O5:
- rozpouštěním ve vodě vzniká kyselina dusičná:
- N2O5 + H2O → 2 HNO3
- rozpouštěním ve vodě vzniká kyselina dusičná:
- kyseliny:
- kyselina dusitá HNO2:
- středně silná jednosytná kyselina
- nestálá, snadno podléhá oxidaci i redukci
- její vodný roztok se získá reakcí dusitanů s neoxidujícími kyselinami:
- AgNO2 + HCl → HNO2 + AgCl
- příprava:
- N2O3 + H2O → 2 HNO2
- kyselina dusitá HNO2:
-
-
- používá se při výrobě barviv (především její soli – dusitany → azobarviva)
- její soli dusitany MNO2 jsou dobře rozpustné ve vodě
-
-
- kyselina dusičná HNO3:
- silná jednosytná kyselina
- čistá je bezbarvá
- světlem se rozkládá na NO2, H2O a O2 (oxid dusičitý pak způsobuje žluté zabarvení), proto se uchovává v tmavých lahvích
- s vodou je neomezeně mísitelná
- koncentrovaná je 68%
- silné oxidovadlo, oxiduje skoro všechny kovy, pouze:
- Au a některé platinové kovy (Pt, Rh, Ir, Nb, Ta) reagují jen s lučavkou královskou, což je směs HNO3 a HCl v poměru 1:3
- Fe, Cr a Al se v koncentrované HNO3 pasivují, tzn. pokrývají se vrstvou oxidů, které brání další reakci, a reagují proto pouze se zředěnou kyselinou
- bílkoviny jejím působením žloutnou (xantoproteinová reakce – důkaz bílkovin)
- příprava – rozkladem dusičnanu sodného kyselinou sírovou:
- NaNO3 + H2SO4 → NaHSO4 + HNO3
- průmyslová výroba – nepřímou katalytickou oxidací amoniaku:
- 1. syntéza amoniaku:
- N2 (g) + 3 H2 (g) — Fe, 450 °C, MPa -> 2 NH3 (g)
- 2. oxidace amoniaku:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
- 3. oxidace oxidu dusného:
- 2 NO + O2 → 2 NO2
- 4. reakce oxidu dusičitého s vodou:
- 3 NO2 + H2O → 3 HNO3 + NO
- 1. syntéza amoniaku:
- kyselina dusičná HNO3:
-
- použití – výroba organických barviv, léčiv (např. nitroglycerin), celulózních laků, výbušnin, dusíkatých hnojiv a dusičnanů
- její soli jsou dusičnany MNO3:
- rozpustné ve vodě
- při vyšších teplotách mají oxidační vlastnosti
- termicky se rozkládají na dusitany až oxidy
- lze je získat reakcí kyseliny dusičné s kovy, oxidy kovů nebo uhličitany
- CuO + 2 HNO3 → Cu(NO3)2 + H2O
- zvýšené koncentrace dusičnanů a dusitanů v potravinách jsou zdravotně závadné
- dusíkaté deriváty uhlovodíků:
- nitrosloučeniny R – NO2
- aminy
- primární R – NH2
- sekundární R2NH
- terciární R3N
- heterocykly (např. pyridin, pirimidin, purin)
- bílkoviny
- nukleové kyseliny
Fosfor
- výskyt:
- v přírodě se nachází jen ve sloučeninách:
- anorganické – minerály apatit a fosforit Ca5F(PO4)2 (mají stejné složení, ale odlišnou strukturu), Ca3(PO4)2 – složka kostí a zubů živočichů
- organické – nukleové kyseliny, fosfolipidy, koenzymy NAD a NADP, ATP
- patří mezi biogenní prvky (kosti, zuby, nukleové kyseliny, ATP)
- v přírodě se nachází jen ve sloučeninách:
- vlastnosti a reakce:
- fyzikálními vlastnostmi se podobá kovům o znám je ve třech modifikacích (červený, bílý, černý):
- bílý (žlutý) fosfor P4:
- voskově měkký, lehce se krájí
- ve tmě světélkuje
- ve vodě nerozpustný, rozpustný v CS2
- prudce jedovatý, značně reaktivní
- na vzduchu samozápalný (proto se uchovává pod vodou):
- P4 + 5 O2 → P4O10
- červený (fialový) fosfor Pn:
- méně reaktivní než bílý
- nejedovatý, ve vodě i v CS2 nerozpustný
- vzniká zahříváním bílého fosforu v inertní atmosféře
- barva tmavočervená, hnědá i fialová (záleží na způsobu přípravy)
- tvoří řetězce
- bílý (žlutý) fosfor P4:
- fyzikálními vlastnostmi se podobá kovům o znám je ve třech modifikacích (červený, bílý, černý):
-
- černý fosfor = kovový:
- krystalická, tmavě šedá látka s kovovým leskem
- dobře vede el. proud a teplo
- nejstabilnější a nejméně reaktivní
- vrstevnatá struktura
- vzniká zahřátím červeného fosforu nad teplotu 400 °C za vysokého tlaku
- vazebné možnosti fosforu jsou podobné jako u dusíku, charakter vazeb s kovy i nekovy je většinou kovalentní
- ve sloučeninách nabývá oxidačních čísel –III a V
- na rozdíl od dusíku netvoří fosfor vodíkové můstky
- černý fosfor = kovový:
- výroba:
- bílý fosfor se vyrábí z apatitu redukcí koksem v přítomnosti křemene v el. peci
- červený fosfor se vyrábí přeměnou bílého fosforu za nepřístupu vzduchu při teplotě 350 °C
- laboratorně se fosfor obvykle nepřipravuje
- použití:
- bílý:
- dříve k výrobě samozápalných leteckých pum a dělostřeleckých granátů (způsobuje těžké popáleniny) – dnes zakázáno
- výroba jedovatých nástrah k hubení hlodavců
- výroba farmaceutických preparátů
- bílý:
-
- červený:
- schopen vzplanout při silnějším zahřátí (např. třením) → zápalky (na škrkátku) a pyrotechnika
- příprava téměř všech sloučenin fosforu (např. kyseliny fosforečné, fosfátů)
- černý:
- v elektrotechnice při výrobě polovodičů typu N
- v menším množství se přidává do slitin kovů (do pájek, bronzu, speciálních ocelí) – zvyšuje tvrdost
- červený:
- bezkyslíkaté sloučeniny fosforu:
- fosfan PH3:
- je obdobou amoniaku, ale vazba P – H je slabší než N – H
- za běžných podmínek bezbarvý, prudce jedovatý plyn nepříjemného česnekového zápachu
- čistý je na vzduchu samozápalný
- má redukční vlastnosti
- difosfan P2H6
- fosfidy – sloučeniny fosforu s elektropozitivnějšími prvky (např. fosfid vápenatý Ca3P2)
- halogenidy fosforu
- fosfan PH3:
- oxidy:
- tvoří dimery
- oxid fosforitý P4O6:
- bílá, jedovatá, vosku podobná krystalická látka, snadno tající
- vzniká spalováním fosforu za omezeného přístupu vzduchu:
- P4 + 3 O2 → P4O6
- je kyselý, s vodou poskytuje roztok kyseliny fosforité
- snadno se oxiduje
- oxid fosforečný P4O10:
- bílá, sněhu podobná sloučenina, která při teplotě 358,9 °C sublimuje
- vzniká spalováním fosforu v nadbytku vzduchu a ochlazením par ve velkých komorách:
- P4 — O2 -> P4O6 – O2 -> P4O10
- má mimořádnou dehydratační schopnost, proto se často používá jako sušidlo
- po osvětlení zeleně světélkuje
- kyseliny:
- kyselina fosforitá H3PO3:
- bezbarvá krystalická látka, ve vodě dobře rozpustná
- má hygroskopické účinky
- používá se jako redukční činidlo
- kyselina trihydrogenfosforečná H3PO4:
- = kyselina ortofosforečná
- trojsytná, středně silná kyselina
- ve vodných roztocích je dvojsytná
- je stálá, nemá oxidační vlastnosti
- většinu kovů nerozpouští (dochází k pasivaci)
- krystalická čirá látka
- při zahřívání dochází ke vzniku kyseliny metafosforečné:
- H3PO4 (HPO3)n
- vznik:
- P4O10 + 6 H2O → 4 H3PO4
- kyselina fosforitá H3PO3:
-
-
- vyrábí se rozkladem fosforečnanů kyselinou sírovou
- použití:
- ve farmacii jako přísada do roztoku peroxidu vodíku (zpomaluje jeho rozklad)
- výroba průmyslových hnojiv (např. superfosfát), léčiv, pracích prostředků
- povrchová úprava kovů
- zpracování ropy
- výroba nealkoholických nápojů – okyselování (např. Coca Cola)
- výroba zubních tmelů
- tvoří tři řady solí:
- dihydrogenfosforečnany MH2PO4
- hydrogenfosforečnany M2HPO4
- fosforečnany M3PO4
- dihydrogenfosforečnany jsou ve vodě rozpustné, hydrogenfosforečnany a fosforečnany jsou rozpustné jen jako soli alkalických kovů
- fosforečnany se používají jako změkčovadla vody v pracích prášcích
- fosforečnan vápenatý Ca3(PO4)2:
- obsažen v minerálech fosforitu a apatitu
- ve vodě nerozpustný
- surovina pro výrobu fosforečných hnojiv – např. superfosfát
- Ca3(PO4)2 + 2 CaSO4 . 2 H2O
-
- ATP:
- adenosintrifosfát o univerzální makroergická sloučenina tvořící spojovací článek mezi exergonickými a exergonickými reakcemi
- tvoří se z ADP (adenozindifosfátu) navázáním zbytku kyseliny fosforečné v procesu nazývaném fosforylace
- energie se uvolňuje hydrolýzou makroergických vazeb mezi fosfátovými zbytky – na 1 mol je to 33 kJ
Hnojiva
- slouží k výživě rostlin, k dodávání minerálních látek (především C, N, P, K, Ca, Mg, S)
- minerální látky jsou přijímány rozpuštěné ve vodě – ta je zdrojem H a O
- dále jsou potřeba i stopové prvky (B, Mn, Zn, Cu, Co, Mo, Si, Na, Cl,…)
- dusík:
- podporuje bujný růst, sytě zelenou barvu rostlin, hodně listů
- způsobuje malou odolnost vůči chorobám a málo plodů – ty jsou netrvanlivé, nevybarvené, bez vůně
- při nedostatku jsou rostliny malé, slabé, neduživé, světle zelené, listy i plody předčasně opadávají
- dobré je hnojit jím na jaře
- fosfor:
- podporuje růst květů a plodů, které jsou krásně voňavé a vybarvené
- zkracuje vegetační období
- při nedostatku mají rostliny málo květů, které jsou malé a zasychají, plody opadávají, jsou chuťově nevýrazné a vybledlé, listy mají červené žilky
- draslík:
- je potřebný na konci vegetačního období
- způsobuje vysokou odolnost vůči mrazu, plísním a chorobám
- při nedostatku – malá odolnost vůči suchu a mrazu, rostliny se snadno lámou a kroutí se jim listy
- vápník:
- důležitý pro kořenový systém a pro tvorbu pevných větví, silné kůry, kmene a slupky plodů
- při nedostatku jsou rostliny málo zakořeněné
- důležitý je hlavně na podzim
- hořčík:
- je součástí chlorofylu → sytě zelené listy
- síra:
- součást bílkovin a rostlinných silic
- železo:
- podporuje tvorbu chlorofylu
- stopové prvky:
- bor – důležitý pro květy a plody
- hliník – součást buněčných stěn
- křemík, sodík, chlor – součást katalyzátorů
- měď – důležitá pro tvorbu chlorofylu
- molybden – podporuje činnost půdních bakterií
- statková hnojiva (přírodní) – hnůj, trus, kompost (organické zbytky + vápno + zemina), močůvka, zelené hnojení
- průmyslová (syntetická hnojiva):
- jednosložková:
- N – NaNO3, KNO3, Ca(NO3)2, NH3, NH4+
- P – Ca(H2PO4)2, superfosfát
- K – KCl, K2SO4, K2O
- vícesložková:
- NPK 1 (obsahuje nejvíc N), NPK 2 (obsahuje nejvíc P), NPK 3 (obsahuje nejvíc K)
- Cererit (NPK + mikroprvky)
- floran
- jednosložková:


