
Otázka: Halogeny, p 5 prvky
Předmět: Chemie
Přidal(a): Karina Lazárková
Postavení prvků v Psp
- ze slova halos = sůl = solitvorné nekovové prvky F, Cl, Br, I a radioaktivní polokov At
- mají sedm valenčních elektronů
- můžou mít pestrá ox. čísla
- tvoří VII. A skupinu PSP (17. skupina)
- za běžných podmínek tvoří dvouatomové molekuly
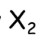
- el. konfigurace:
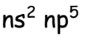
Jednotlivé prvky – F,Cl,Br,I,At
- Všechny prvky jsou: jedovaté, dráždivé a dvouatom. molekuly
- Slučují se přímo s kovy i nekovy
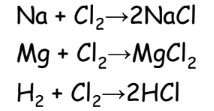
Fluor
Charakteristika:
- zelenožlutý plyn má největší elektronegativitu – nejsilnější oxidační činidlo
- biogenní prvek
Výskyt:
- kosti, zubní sklovina – při nedostatku roste kazivost zubů
- pouze ve sloučeninách, nejčastěji v halogenidech (soli halogenvodíků)
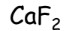 – kazivec = fluorit
– kazivec = fluorit- HF – kys. fluorovodíková
Vlastnosti:
- špatně rozpustné ve vodě – rozpustnost v PSP klesá, jsou rozpustné v nepolárních rozpouštědlech (benzín, sirouhlík)
- je jedovatý, dráždí dýchací cesty
- charakteristický zápach – v PSP klesá intenzita zápachu a „jedovatost“ prvků
- má nejsilnější oxidační vlastnosti
- je nejreaktivnější prvek – tvoří sloučeniny i se vzácnými plyny
Výroba:
- elektrolýzou roztoků nebo tavenin halogenidů
Význam:
- stomatologie – prevence proti zubnímu kazu → posiluje zubní sklovinu (zubní pasty a ústní
vody - freony – chladicí kapaliny
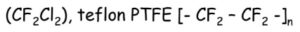
Chlor
Charakteristika:
- žlutozelený plyn, méně reaktivní než F
- Biogenní prvek
Výskyt:
- žaludeční šťávy (HCl) – podílí se na trávení, součást krevní plazmy
- pouze ve sloučeninách, nejčastěji v halogenidech (soli halogenvodíků) – halogeny se běžně v přírodě vyskytují i ve formě iontů – mořská a minerální voda – chloridy
- NaCl – sůl kamenná = halit
- KCl – sylvín
Vlastnosti:
- špatně rozpustné ve vodě – rozpustnost v PSP klesá, jsou rozpustné v nepolárních rozpouštědlech (benzín, sirouhlík)
- charakteristický zápach – v PSP klesá intenzita zápachu a „jedovatost“ prvků (Cl – bojová chemická látka za WWI.)
- velmi reaktivní
- vysoká elektronegativita
- reaguje s kovy i nekovy
Výroba:
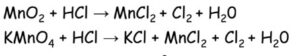
- elektrolýzou roztoků nebo tavenin halogenidů (chlor ze solanky = nasycený roztok NaCl)
Elektrolýza solanky:
- chlor se vylučuje na anodě
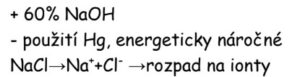
amalgámový způsob
- solanka v elektrolyzéru protéká po vrstvě rtuti, se kterou sodík tvoří slitinu – amalgám
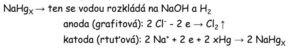
Význam:
- HCl, bělící prostředky (bělení vláken, SAVO = NaClO), dezinfekční prostředky (ničí ve
vodě bakterie), organická rozpouštědla (CHCl3), plast PVC, výroba pesticidů, insekticidů, léčiv, freonů; salmiak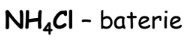 .
.
Brom
Charakteristika:
- červenohnědá těkavá kapalina, leptá pokožku, mísí se s vodou (málo rozpustný) – bromová
voda
Výskyt:
- chaluhy, mořské řasy, houby, korály
Vlastnosti:
- špatně rozpustné ve vodě – rozpustnost v PSP klesá, jsou rozpustné v nepolárních rozpouštědlech (benzín, sirouhlík)
- velmi reaktivní
Význam:
- barviva, léčiva (NaBr působí jako sedativum), AgBr – černobílé fotografie, filmy, foto-grafické papíry, emulze na fotky, farmaceutický průmysl – lék Bromhexin na kašel
Jod
Charakteristika:
- pevná krystalická látka, tvoří tmavě šedé až fialové krystaly s kovovým leskem, za zvýšené teploty sublimuje (tvoří fialové páry) = přeměna pevné látky na plynnou a potom zase na pevnou, není rozpustný ve vodě (v etanolu ano)
- biogenní prvek
Výskyt:
- pouze ve sloučeninách
- štítná žláza (hormon thyroxin)
Vlastnosti:
- špatně rozpustné ve vodě – rozpustnost v PSP klesá, jsou rozpustné v nepolárních rozpouštědlech (etanol – jód)
- škrob se barví jodem tmavomodře až černě
- velmi reaktivní
- vysoká elektronegativita
Význam:
- dezinfekce ran – jodová tinktura (5 %-ní roztok jodu v etanolu), jodisol = komplexní sloučenina jodu, jodoform
 – antiseptické účinky – dezinfekce, Lugolův roztok = roztok jodu v roztoku KI – důkaz škrobu, jodoformová reakce
– antiseptické účinky – dezinfekce, Lugolův roztok = roztok jodu v roztoku KI – důkaz škrobu, jodoformová reakce - výroba barviv
Halogenvodíky
- vznikají přímým slučováním prvků
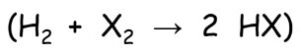 nebo reakcí silných kyselin a halogenidů
nebo reakcí silných kyselin a halogenidů 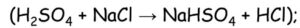 intenzita reakce s vodíkem v PSP klesá, halogeny se při reakci s vodíkem odbarvují
intenzita reakce s vodíkem v PSP klesá, halogeny se při reakci s vodíkem odbarvují- některé halogenvodíky vznikají jako vedlejší produkty organických syntéz
- jsou to ostře páchnoucí, bezbarvé, štiplavé plyny, které ve vlhkém prostředí tvoří mlhu
- jsou dobře rozpustné ve vodě – rozpouštěním vznikají halogenovodíkové kyseliny
Reakce:
- halogenid s halogenem – vytěsňování halogenu z halogenidu

Fluorovodík HF
- bezbarvý plyn, štiplavý zápach, teplota varu je nízká, je velmi jedovatý (i jeho vodný roztok)
- leptá sklo
- výroba teflonu
Chlorovodík HCl
Výroba: ![]()
- rozpouští se ve vodě a tím vzniká kyselina chlorovodíková
Použití:
- výroba plastů (PVC), čištění kovů, organické syntézy – výroba halogenových derivátů uhlovodíků
Bromovodík HBr
- vlastnosti shodné s HCl, připravuje se:
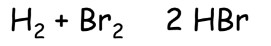
Jodovodík HI
- méně stálý než HCl; jeho vodný roztok je nejsilnější kyselina
- připravuje se např.:
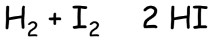
Kyslíkaté sloučeniny
Oxidy
- halogeny se s kyslíkem přímo neslučují, proto kyslíkaté sloučeniny halogenů nelze připravit
přímou syntézou prvků - sloučeniny mají menší technický význam; oxidy jsou nestálé a reaktivní – za normální teploty se rozkládají, jsou to dobrá oxidační činidla

Kyslíkaté kyseliny
- většina existuje pouze ve vodném roztoku
![]()
- s růstem oxidačního čísla halogenu roste síla a její stabilita, ale klesají oxidační schopnosti, protože roste pevnost vazby Cl-O a tím klesá schopnost kyslíkaté kyseliny odštěpit kyslík
- z hlediska centrálního atomu roste síla kyseliny s jeho protonovým číslem (tedy v pořadí F – Cl – Br – I)
Kyselina Chlorná HClO
- velmi slabá kyselina (nejslabší) – obsažena ve chlorové vodě – bazény
- má silné oxidační a bělící schopnosti
- za běžných podmínek je nestálá a snadno se rozkládá i za normální teploty
Kyselina Chloritá ![]()
- nejméně stálá oxokyselina chloru – existuje jen jako vodný roztok
- soli se po zahřátí mění na chlorečnany a chloridy nebo na chloristany a chloridy
Kyselina chlorečná ![]()
- nestálá silná kyselina, silné oxidační činidlo
- výroba výbušnin
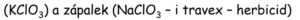
Kyselina chloristá ![]()
- nejsilnější kyslíkatá kyselina chloru – stálá, bezbarvá, olejovitá kapalina
- je hygroskopická = pohlcuje vodu
- velmi nebezpečná – vybuchuje při zahřátí, nárazu; ve styku s organickými látkami se explozivně rozkládá – vzniká reakcí
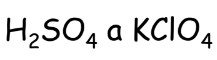
Soli kyselin:
- Chlornany, chloritany – dezinfekční a bělící prostředky
- Chlorečnany, chloristany – výbušniny, zápalky, pyrotechnika.
Další podobné materiály na webu:

