![]()
Otázka: Průběh chemických reakcí
Předmět: Chemie
Přidal(a): Tomáš H.
1) Uveďte, čím se zabývá termochemie, charakterizujte děj exotermický a endotermický:
- definice termochemie – zkoumá tepelné změny v průběhu chemické reakce, rozdíl mezi energií
reaktantů a produktů
– z chemického hlediska se dělí na exotermické a endotermické - exotermické děje – děje, které uvolňují teplo při reakci, např.: C + O2 -> CO2 + 393 kJ
- endotermické děje – děje, které při reakci teplo spotřebovávají, např.: N2 + O2 -> 2 NO – 197 kJ
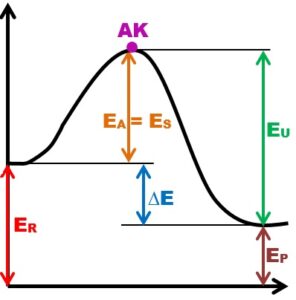
2) Popište graf průběhu exotermické reakce (reakční koordinátu), vysvětlete jednotlivé fáze děje:
- reakce je zahájena štěpením vazeb v molekulách
-> je nutno dodat energii – energie spotřebovaná/ aktivační ES/A
N ≡ N a H – H, H – H, H – H - rozštěpením původních chemických vazeb v reaktantech se vytvoří
aktivovaný komplex(AK) z více – méně samostatných částic – atomů
6x H , 2x N - vlivem reakčních podmínek se tvoří nové chem. vazby mezi atomy
H a N – vzniká produkt NH3. Tvorba chem. vazeb je provázena uvol-
ňování energie – EU. Produkty se tvoří až do vzniku stavu dynamické
rovnováhy reaktantů a produktů (tento stav je ovlivnitelný reakčními
podmínkami. N2 + 3H2 NH3 - porovnáním hodnot ES a EU zjistíme, zda je děj exo či endtermický
a vypočítaný rozdíl doplníme do rce -> vznikne termochemická rce - ∆E – tepelné zabarvení reakce, ∆E = EU – ES = ER – EP
3) Vypočítejte reakční teplo Qm z hodnot vazebných energií a posuďte, zda jde o děj exo či endoterm.:
- postup:
3 H2 + N2 -> 2 NH3 + 83kJ EV(H-H)= 435 kJmol-1, EV(H-N)= 350 kJmol-1, EV(N≡N)= 712 kJmol-1Qm = – ∆E = ES – EU
ES < EU
=> Qm = ES – EU = [EV(N≡N) + 3 EV(H-H)] – [6 EV(N-H)] = [712 + 3*435] – [6 * 350] = 2017 – 2100 = – 83 kJmol-1 => děj exotermický
– Qm = měrné reakční teplo -teplo vyměňované reakčním systémem s okolím na 1mol reak. proměn
4) S požitím termochemických zákonů vypočítejte neznámé reakční teplo. Uveďte znění termochemických zákonů:
- termochemické zákony umožňují výpočet reakčního tepla
- 1. TERMOCHEMICKÝ Z. – Laplace – Lavoisierův – 1780
– reakční teplo (teplené zbarvení) přímé a zpětné reakce je číselně stejné,
liší se pouze znaménkem: Qm (přímé reakce) = – Qm (zpětné reakce) - 2. TERMOCHEMICKÝ Z. – Hessův – 1840
– celkové reakční teplo Qm chemické reakce nezávisí na průběhu reakce,
ale pouze na počátečním a konečném stavu: (Qm)3 = (Qm)1 + (Qm)2
Sn + Cl2 -> SnCl2 Qm= ?
Sn + 2 Cl2 -> SnCl4 Qm= – 544,6 kJmol-1
SnCl4 -> SnCl2 + Cl2 Qm= 195,2 kJmol-1(Qm)3 = (Qm)1 + (Qm)2 -> (Qm)1 = (Qm)3 – (Qm)2
= – 544,6 – (-195,2)
(Qm)1 = – 349,4 kJmol-1
=> děj exotermický
5) Definujte obor reakční kinetika:
- definice – obor zabývající se průběhem chemické reakce – zkoumá rychlost reakce a faktory, které
rychlost reakce ovlivňují: účinnost srážky, teplota, koncentrace reaktantů, vliv
katalyzátorů, vliv velikosti povrchu reaktantů. Při znalosti vlivu faktorů na průběh reakce
je možno stanovit optimální podmínky reakce - pro reakční rychlost platí vztah: v ↑↓ EA => reakční rychlost je nepřímo úměrná aktivační energii
6) Popište zobrazenou reakční koordinátu děje:
N2 + O2 -> 2 NO Qm = 197 kJmol-1
=> jedná se o děj endotermický, musíme dodávat energii
po dobu reakce
- reakce je zahájena štěpením vazeb v molekulách:
N ≡ N , O = O - vznik aktivačního komplexu: 2x N , 2x O
- tvorba nových molekul: 2x NO
- tepelné zabarvení reakce
ER – EP = EU – ES = ∆E => záporné číslo – jedná se exotermický děj
7) Diskutujte vliv faktorů na průběh uvedené reakce (srážková teorie, teplota, koncentrace reaktantů
a produktů – vyjádřete podle Guldberg – Waagova zákona, katalyzátor – doplňte do grafů reakční
koordináty s pozitivním a s negativním katalyzátorem):
- faktory ovlivňující rychlost reakce:
- účinnost srážky
- reagujících částic – udává srážková teorie
- srážka je účinná při dostatečné kinetické energii částic při prostorové orientaci částic
- vliv teploty
- při vyšší teplotě -> vyšší kinetická energie částic -> rychlejší vznik aktivovaného komplexu, a tím i produktů – platí vztah: v ↑↑ T
- při zvýšení teploty o 10°C vzroste reakční rychlost asi 2 – 3x
- vliv koncentrace reaktantů:
- platí Guldberg – Waagův zákon: rychlost chemické reakce je přímo úměrná součinu molárních
koncentrací reaktantů
- platí Guldberg – Waagův zákon: rychlost chemické reakce je přímo úměrná součinu molárních
v = k * cm(R1) * cm(R2) – R1 a R2 jsou reaktanty
v = k * cm(N2) * cm(O2)
- vliv katalyzátoru:
- jediný faktor, který může snížit (pozitivní katalyzátor, aktivátor) či zvýšit (negativní katalyzátor,
inhibitor) aktivační energii - katalyzátor je látka, která mění rychlost reakce změnou EA a ovlivňuje směr reakce (které produkty
vzniknou). V průbehu reakce se nespotřebovává – po regeneraci je opakovaně použitelný
- jediný faktor, který může snížit (pozitivní katalyzátor, aktivátor) či zvýšit (negativní katalyzátor,
8) Definujte stav dynamické rovnováhy reaktantů a produktů.
- definice – stav, kdy probíhá přímá i zpětná reakce stejnou rychlostí – složení reakční směsi se tedy
nemění - podle Guldberg – Waagova zákona platí:
v1 = k1 * cm(R1) * cm(R2)
v2 = k2 * cm(sloučeniny)2
9) Odvoďte vztah pro rovnovážnou konstantu děje:
H2 + I2 2 HI
v1 = v2 => ROVNOVÁŽNÝ DĚJ
k1*cm(H2) * cm(I2) = k2 * cm(HI)2
KR = k1/k2 = cm (HI)2/ (cm (H2) * cm (I2)
Kr = rovnovážná konstanta = součin molárních koncentrací produktů lomený součinem molárních
koncentrací reaktantů
-
- charakterizuje chemickou reakci – umožňuje určit rozsah průběhu reakce za daných podmínek
(teploty):
Kr > 1 – v rovnovážné směsi převažují produkty
Kr > 104 – zpětná reakce je zanedbatelná, všechny reaktanty zreagovaly na produkty (pouze jedna
šipka – přímá reakce)
Kr = 1 – v rovnovážné směsi je vyrovnaná koncentrace reaktantů a produktů (šipky v obou
směrech – rovnovážný stav)
Kr < 1 – v rovnovážné směsi převládají reaktanty
Kr < 10-4 přímá reakce prakticky neprobíhá, reaktanty téměř nereagují
- charakterizuje chemickou reakci – umožňuje určit rozsah průběhu reakce za daných podmínek
10) Určete optimální podmínky koncentrace roztoků – a) produktů, b) tlak, c) teplota, d) katalyzátor pro výrobu Haber – Boschovou syntézou:
N2 (g) + 3 H2 (g) -> 2 NH3 (g) Qm = – 92,29 kJmol-1 Qm < 0
chemická rovnováha reaktantů a produktů
a) neustále přidávat reaktanty a neustále odebírat produkty
b) 4 moly reaktantů (4*22,41l) -> 2 moly produktů (2*22,41l) => stlačování
c) reakční teplo = – 92,29 kJmol-1 => exotermický děj -> po počátečním impulsu CHLADIT
d) použít katalyzátor – U, U, U – pozitivní => umožní, usměrní, urychlí
– jedná se o plyny => KONTAKTNÍ (práškový) – má velký povrch (např.
práškové železo)
N2 + 3 H2 -> 2 NH3
- srážková teorie – dostatečná kinetická energie částic, musí být správně orientovány
11) Které z uvedených změn posunou rovnováhu reakce ve prospěch oxidu dusnatého?
a) zvýšení teploty, b) snížení teploty, c) snížení tlaku, d) zvýšení tlaku, e) přidání kontaktního
katalyzátoru – zdůvodněte!
N2 (g) + O2 2 NO (g) – 197 kJ
děj je endotermický => ∆E = – 197 kJ => Qm = 197 kJmol-1
- zvyšuje se teplota
- tlak průběh děje neovlivní 2 moly -> 2 moly
- kontaktní katalyzátor s velkým povrchem, protože se jedná o plyny – plynné reakce


