
Otázka: Halogenderiváty
Předmět: Chemie
Přidal(a): Adam Verhulst
Halogenderiváty
- Uhlovodíky: C, H
- Deriváty: další prvky, náhrada H
- R–X (R = uhlovod. zbytek, X = halogen)
Substituce
- A) Iniciace (zahájení) – Cl•, F• (radikály)
- Cl – Cl – Cl• Cl•
- B) Propagace (prodlužování)
- CH4 – CH3Cl – CH2Cl2 – CHCl3 – CCl4 (postupná substituce)
- C) Terminace (ukončení)
- H• + H• – H2 Cl• + Cl• – Cl2 CH3• + Cl• – CH3Cl
Adice
- CH2=CH2 + HCl → C2H5Cl (chlorethan)
Beilsteinova zkouška – přítomnost derivátu plamenem
- CuCl2 – barví plamen zeleně = přítomnost Cl
Odstranění halogenu – Waldenův zvrat – pomocí např. -OH
- = nukleofilní činidlo (-OH) – nukleofilní subst.
CCl4 – tetrachlormethan
- Kapalina, nemísitelná s vodou , nehořlavá, bezbarvá
- Kdysi používaný v hasicím přístroji, ale zakázaný, protože vzniká toxický fosgen (COCl2)
CHCl3 – Trichlormethan (Chloroform)
- Kapalina, bezbarvá, těkavá, nehořlavá, mísitelná s polárníma i s nepolárníma rozpouštědlama
- Leptá plasty, polární i nepolární rozpouštědlo
- Výroba chladícího media freonu
- Silně ovlivňuje nervovou soustavu = působí kolaps nervů
- Narkotické účinky na organismus – kdysi používaný jako anestetikum
CH3Cl – Chlormethan
- Plyn, hoří, reaktivní
- Používaný k methylaci (prodloužení o methyl), k chloraci (prodloužení o chlor)
C2H5Cl – Chlorethan (ethylchlorid, kelén)
- Plyn, bezbarvý, hořlavý
- Lokální anestetikum – zabraňuje bolesti svalů (sprej)
nCH2=CHCl – Chlorethen (vinylchlorid)
- Plyn, jedovatý
- Výroba PVC (polymerací) (3)
- Nepatří do popelnice na plast, protože těžké zpracování
nCH2=CCl-CH=CH2 – 2-chlor-buta-1,3-dien
- -[-CH-CCl=CH-CH2-]-n – chloropren
- Výroba chloroprenového kaučuku (neopren)
nCF2=CF2 – 1,1,2,2-tetrafluorethen
- -[-CF2-CF2-]-n – teflon (polytetrafluorethylen) PTFE

DDT – Dichlordifenyl trichlorethan
- universální insekticid
HCH – 1,2,3,4,5,6-hexachlorocyklohexan (lindan)
- Totální herbicid (zabije všechno)
PCB – Polychlorované bifenyly
- Změkčovač plastů
- (každé číslo = chlor)

CFC – Freony
- Uhlovodíky se zároveň chlorem a fluorem
- 120 let poločas rozpadu
- Ničí ozonovou vrstvu
- Medium chlazení (zdravotně nezávadné – nerozpadá se)
- Halothan – narkotikum na uspání zvířat (operace) C2HBrClF3
- Chloral – narkotikum na uspání lidí (operace) C2HCl3O
CHI3 – Jodoform
- Žlutá jedovatá látka k důkazům
Organokovové sloučeniny
- Na uhlíkatý řetězec se připojí kov s malou elng.
- Grignardovy sloučeniny (sl. s Mg)
- Používají se na prodloužení řetězce
- Odstranění halogenu z řetězce (C3H7MgCl + HCl – MgCl2 + C3H8)
Hydroxyderiváty
- R-O-H
- Polární látky
- Rozpustné v polárních rozpouštědlech
- Alkoholy X Fenoly
- Alkoholy – normální uhlíkatý řetězec + -OH
- CH3-CH2-OH – ethanol (líh)
- Fenoly – Fenyl + -OH
- Alkoholy – normální uhlíkatý řetězec + -OH
Alkoholy
- C2H5OH – jednosytý alk., C2H5(OH)2 – dvojsytý alk., C2H5(OH)3
- Rozdíly při reakci
- Primární alk. = na uhlíku (který drží -OH) jsou 3H, nebo 2H a 1C
- Sekundární alk. = na uhlíku jsou 2C a 1H
- Terciální alk. = na uhlíku jsou 3C a žádný H
- Alkoholy se v přítomnosti kys. chovají zásaditě a za přít. kovu/zás. chovají kys. (jsou amfoterní)
- 2H2O + 2Na – 2NaOH + H2 (vzor)
- 2CH3-O-H + 2Na – 2CH3-O-Na + H2
- Kyselé chování alk. (ztrácí H) – Alkoholát (methanolát sodný)
- H2O + HNO3 – H3O+ + NO3– (H3O+ = hydroxoniový kationt)
- CH3-O-H + HNO3 – CH3OH2+ + NO3–
- Zás. chování alk. (získává H) – Methyloxoniový kationt
- Oxidace – zvýšení ox.č., ztráta e–, +O, -(2)H
- Redukce – snížení ox.č., příjem e–, -O, +(2)H
- CH3OH – (ox.) 2H + CH2=O (aldehyd – methanal = formaldehyd)
- CH2=O -(ox.) CHOOH (karboxylová kys. – methanová kys. = kys. mravenčí)
- Methanol je fuj pro tělo (formaldehyd + kys. mravenčí)
- C2H5OH -(ox.) 2H + CH3CH=O (ethanal – acetaldehyd)
- CH3CH=O – (ox.) CH3COOH (kys. ethanová = kys. octová)
- Ethanol není fuj pro tělo
- Oxidaci s CH3OH a C2H5OH způsobuje enzym alkoholdehydrogenáza (způsobuje kocovinu)
- Všechny alkoholy (kvůli vodíkovým můstkům) jsou sušidla
- Hodně vážou vodu (vysušení kůže dezinfekcí, po alkoholu je žízeň)
- líh = 98% (zbytek H2O) – azeotropní směs (nejdou od sebe oddělit)
- CH3OH – methanol (dřevný líh)
- Těkavá, hořlavá, silně jedovatá kapalina
- Suchá destilace dřeva (především bukového)
- C2H5OH – ethanol (líh)
- Mísitelná látka s vodou (tvoří s vodou vodíkové můstky)
- Kapalina se zápachem, hoří
- Oxidace – ethanol – acetaldehyd – kys. octová
- Esterifikace – estery
- Dezinfekce
- Lihové nápoje – pivo (slad), víno (hrozn. cukr) – různé cukry na jiné nápoje
- C3H7OH – propanol
- n-propanol (primární alk.)
- Isopropanol (sekundární alk.)
- Oxidací isopropanolu – propanon (aceton)
- Oba mají podobné vlastnosti, liší se hlavně reakce (prim. X sekund.)
- C3H8O3 – glycerol (glycerin)
- Propan-1,2,3-triol
- Nemastná látka, přidává se do mýdla, žvýkaček, nápojů, likérů…
- Hodně důležitý v metabolismu
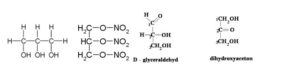
- Glyceroltrinitrát (nitroglycerin) – výroba výbušnin, v menší konc. lék na srdce
- Glycerol – glyceraldehyd (aldehyd) (prim.)
- Glycerol – dihydroxyaceton (keton) (sekund.)
- Vznikají současně ve stejnou dobu
- 2 nejjednodušší cukry v těle
- C6H12O6 – Glukosa
- 1-oxo-2,3,4,5,6-hydroxyheptan
- Rozbíjí se na ty dva cukry z glycerolu
- HO-CH2-CH2-OH – Ethandiol (ethan-1,2-diol) = ethylenglykol
- Prudtraftalenovou
Fenoly
- Fenol
- Pevná krystalická látka, při oxidaci fialová
- „Karbolová voda“ (karbolka) – dezinfekce
- Fenolftalein – indikátor (fialový)
- FF (fenolformaldehydové pryskyřice) – lak na nábytek?
- Trinitrofenol (TNF) – výbušnina
- „Kys. pikrová“ (silně kys. látka)
- Benzen-1,2-diol (benzendiol) (pyrokatechol)
- Benzen-1,3-diol (resorcinol)
- Benzen-1,4-diol (hydrochinon)
- Při fotografování se používají všechny tři



